CAR-T 細胞新突破:無細胞療法能否改寫癌癥治療規則?
發布時間:2025-08-21

近年來,癌癥免疫治療領域的明星——CAR-T 細胞療法,以 “改造患者自身免疫細胞攻擊癌細胞” 的創新機制,在白血病、淋巴瘤等血液腫瘤中展現了突破性療效。然而,這種 治療方法也面臨著嚴峻挑戰:可能引發嚴重的細胞因子釋放綜合征(發熱、器官衰竭等)、對實體腫瘤滲透能力有限、制備成本高昂等。
有沒有一種方法,既能保留 CAR-T 細胞的抗癌威力,又能規避這些風險?科學家將目光投向了細胞間通訊的 “納米信使”——外泌體。最近一項發表在《Stem Cell Research & Therapy》的綜述指出,CAR-T 細胞衍生的外泌體(簡稱 CAR-T 外泌體)可能成為下一代癌癥治療的關鍵突破點。
外泌體是細胞分泌的一種微小囊泡(直徑約 30-150 納米),就像細胞間的 “快遞包裹”,內部攜帶蛋白質、RNA 等生物分子,負責在細胞間傳遞信號。幾乎所有細胞都能分泌外泌體,其內容物反映了來源細胞的特性。例如,免疫細胞的外泌體可傳遞免疫信號,癌細胞的外泌體則可能幫助腫瘤逃避免疫攻擊。
天然優勢
①體積小:能穿透傳統藥物難以到達的組織(如實體腫瘤的致密基質);
②低免疫原性:作為 “無細胞” 載體,引發免疫反應的風險遠低于活細胞;
③可修飾性:能通過基因工程加載特定靶向分子或藥物。
而CAR-T 外泌體,正是從經過基因改造的 CAR-T 細胞中提取的外泌體。它們繼承了 CAR-T 細胞的 “抗癌武器”——表面攜帶識別癌細胞的嵌合抗原受體(CAR),同時具備外泌體的獨特優勢,成為精準打擊癌細胞的 “納米導彈”。
規避 “細胞因子風暴” 風險
CAR-T 細胞療法最危險的副作用是細胞因子釋放綜合征(CRS)—— 大量活化的 CAR-T 細胞釋放過量炎癥因子,可能導致高熱、低血壓甚至器官衰竭。而CAR-T 外泌體的作為 “無細胞” 療法,不會在體內增殖,也不會持續釋放細胞因子,從根源上降低了 CRS 的發生風險。臨床前研究顯示,CAR-T 外泌體在發揮抗癌作用的同時,幾乎不引發類似 CAR-T 細胞的全身炎癥反應。
突破實體腫瘤 “壁壘”
實體腫瘤(如肺癌、乳腺癌、胰腺癌)之所以難治,在于其復雜的腫瘤微環境:致密的細胞外基質和低氧環境阻礙 CAR-T 細胞滲透以及腫瘤分泌抑制性分子(如 PD-L1),“阻礙” 免疫細胞發揮作用。
CAR-T 外泌體的優勢在于:輕松穿越腫瘤基質,到達 CAR-T 細胞難以觸及的深部癌細胞;不表達 T 細胞表面分子,不易被腫瘤微環境中的抑制信號干擾;可同時攜帶化療藥物(如紫杉醇)和免疫激活分子,實現 “化療 + 免疫治療” 雙重攻擊。
“現成療法” 降低成本與門檻
CAR-T 細胞療法是需要對每位患者進行“量身定制”,制備周期長(數周)、成本高昂(數十萬美元)。而CAR-T 外泌體可通過標準化生產(如大規模培養 CAR-T 細胞后提取外泌體),制成 “通用型” 藥物,大幅降低成本,縮短治療周期。此外,外泌體穩定性高,便于儲存和運輸,更適合臨床普及。
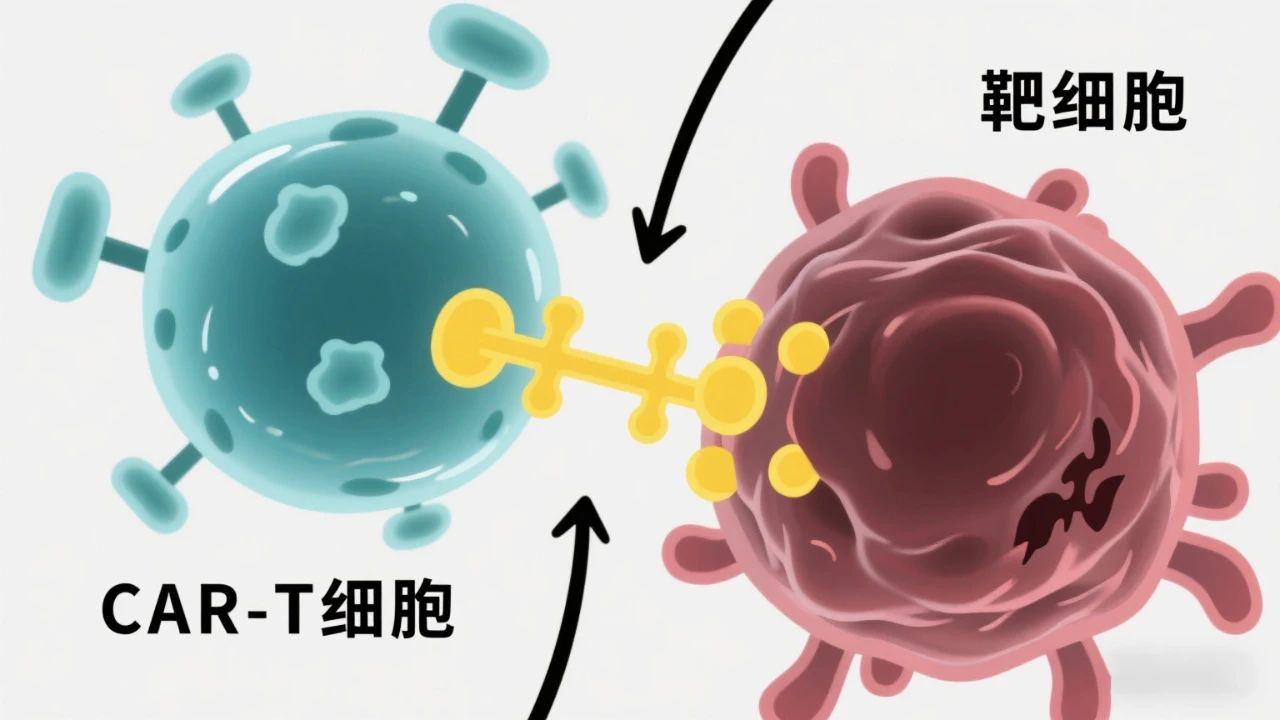
目前,CAR-T 外泌體已在多種癌癥模型中展現潛力,部分研究已進入臨床前階段:
1. 血液腫瘤:延續 CAR-T 的輝煌
研究進展:在白血病、淋巴瘤模型中,CAR-T 外泌體通過表面 CAR 精準識別癌細胞(如 CD19 陽性細胞),釋放穿孔素、顆粒酶等毒性分子,直接誘導癌細胞凋亡。與 CAR-T 細胞相比,其療效相似,但 CRS 風險顯著降低。
2. 實體腫瘤:攻克 “治療盲區”
肺癌:靶向 EGFRvIII(肺癌常見抗原)的 CAR-T 外泌體,可穿透腫瘤組織,抑制腫瘤生長,聯合紫杉醇加載的外泌體,能同時誘導癌細胞死亡和免疫激活。
乳腺癌:針對間皮素(MSLN)的 CAR-T 外泌體,在三陰性乳腺癌模型中顯著縮小腫瘤,且無明顯毒性。
膠質母細胞瘤:利用外泌體穿越血腦屏障的能力,靶向遞送抗癌分子,為治療膠質母細胞瘤提供了新思路。
盡管前景廣闊,CAR-T 外泌體仍需突破以下瓶頸:
①規模化生產:目前外泌體提取依賴超速離心等復雜技術,需開發更高效的工業化生產工藝;
②靶向精準性:部分腫瘤抗原存在異質性(癌細胞表面抗原不一致),需優化 CAR 設計,實現更廣譜的靶向;
③長期安全性:外泌體在體內的代謝路徑、潛在蓄積風險仍需深入研究;
④臨床轉化:需開展更多動物實驗和臨床試驗,驗證其在人體中的療效與安全性。
CAR-T 細胞療法的誕生,標志著癌癥治療從 “化學藥物” 邁向 “活細胞藥物” 時代;而 CAR-T 外泌體的興起,可能引領下一次革命 ——“無細胞免疫治療”。這種“納米級抗癌武器” 兼具精準性、安全性和靈活性,有望突破傳統療法的局限,為血液腫瘤和實體腫瘤患者帶來新希望。
參考文獻
Sani F, et al. CAR-T cell-derived exosomes: a new perspective for cancer therapy. Stem Cell Res Ther. 2024;15:174.
注:本文僅供科普參考,具體治療方案請遵醫囑。

 0311-86576536
0311-86576536 新聞中心
新聞中心 風采展示
風采展示 信息公告
信息公告
 公眾號
公眾號 視頻號
視頻號

